SEMANA 11

MODELO ACTUAL DEL ÁTOMO
El modelo actual del átomo fué creado por cuatro científicos ganadores cada uno de premios NOBEL, ellos fueron:
-Heisemberg.
-L. Paulins.
-Schrödinger.
-Sommerfield.
Este modelo fue basado en los estudios de la mecánica cuántica propuesta por Albert Einstein y el comportamiento dual de la luz.
El modelo actual es un modelo matemático, que al resolver sus ecuaciones se llega a los números cuánticos que sirven para formular el modelo.
Actividad Inicial
Vimos un video sobre la germinación de hongos, y de las plantas, vimos como saltan el río los salmones para poder reproducirse. El video nos enseña lo impresionante que es la naturaleza, y nos motiva a cada día interesarnos más por ella.
Modelo atómico (Continuación...)
En el átomo se encuentran dos partes fundamentales: El núcleo y la corteza.
El núcleo: Es la parte central del átomo, en el se encuentra la mayor parte de la masa de éste, está formado por: los protones (pt) descubiertos por Rutherford y los neutrones (n°) descubiertos por Chadwirck.

La corteza: Está formada por los niveles e energía, que a su vez los forman los electrones, no todos los electrones tienen la misma cantidad de energía y por ello los que se encuentran más cerca del núcleo, poseen menor energía y los que están más lejos poseen mayor cantidad de energía.
Números cuánticos
°Número cuántico principal (n): Forma los niveles de energía y toma los valores enteros de 1 en adelante (1,2,3,4,5,6,7...) o por las letras K,L,M,N,O,P,Q.
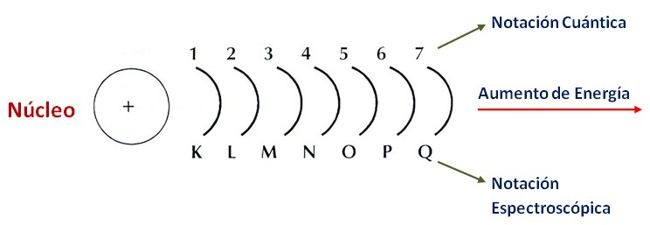
°Segundo número cuántico (l): Llamado también azimutal o subniveles el segundo número cuántico (l) determina la forma del orbital, su valor depende del n (nivel) y toma los valores entre 0 y (n-1)-
n= 1 = xl? 0,0
n= 2 = 0,1
n= 3 = 0,1,2
n= 4 = 0,1,2,3
-Orbitales: Es el espacio volumétrico donde existe la mayor probabilidad de encontrar un electrón en un momento determinado.
Dibujo de los orbitales:
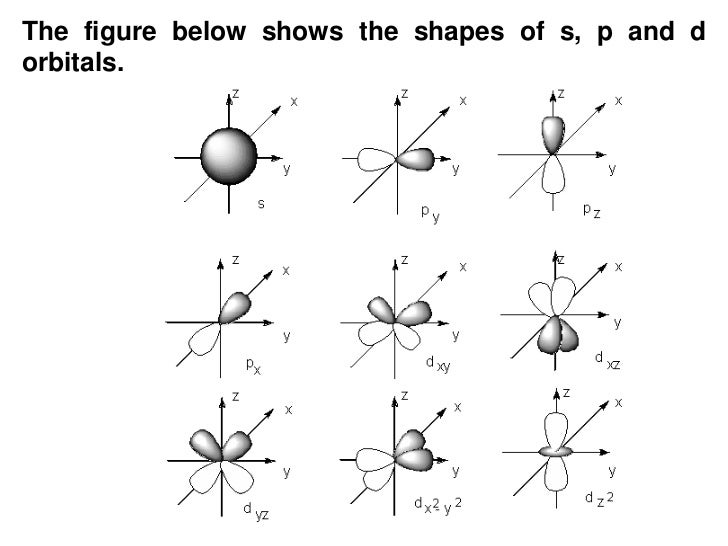
l=2
ml= -2, -1, 0, 1, 2

°Cuarto número cuántico (ms): También llamado Spin, representa el giro del electrón en un eje imaginario, si rota en el sentido de las manecillas de reloj su valor es +1/2 y si rota en sentido contrario es -1/2.

Actividad inicial
La Motivación
Distribución electrónica
Nos sirve para ubicar los electrones que tiene un átomo en los niveles y subniveles de energía.

Regla de HUND: Para llenar los orbitales se hace de izquierda a derecha con los espines paralelos.
Período: Lo da el nivel mayor de la distribución.
Grupo: Lo da los electrones del último nivel.
Comentarios
Publicar un comentario