SEMANA 33
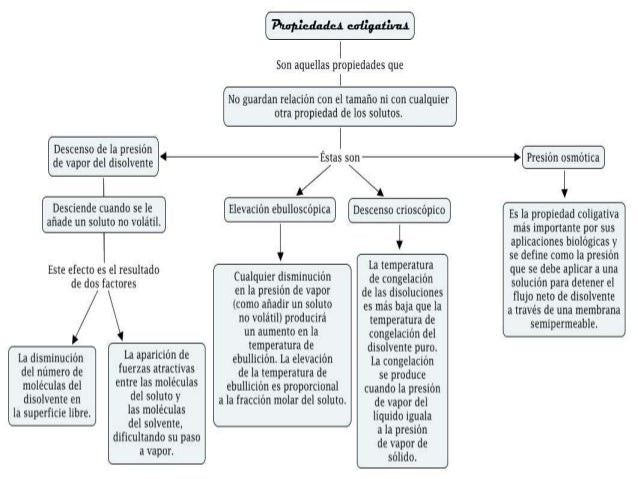
Presión osmótica: La presión osmótica es la fuerza que debe aplicarse sobre la superficie de la una solución que contiene mayor cantidad de soluto para detener el paso del solvente hacia ella. La presión osmótica aumenta cuando se le añade a un solvente, un soluto no volátil.

Isotónico: Es aquel que contiene una concentración de sales aproximadamente igual a la concentración de sal de la célula o del organismo.
Hipotónico: Es aquel que contiene menos concentración de sal que la célula o el organismo.
Hipertónico: Es aquel que contiene mayor concentración de sal que la célula o el organismo.
Formas de expresar la concentración de las soluciones en forma cuantitativa.
n= w/PM
n= # de moles
w= peso en gramos
PM= peso molecular.
Equivalente-gramo (eq-g)
Es la cantidad de sustancia que puede producir un mol o una mol de cargas positivas y negativas.
Eq-g ácido= PM/#H+
Eq-g base= PM/#OH-
Eq-g sal= PM/C+ ó C-
Ejemplo:
1. Cuántas moles y cuántos eq-g hay en 10g de H2SO4 y 5g de KOH y 1g de Ca3(PO4)2?
Ca= 40
P=31
O=16
S=32
K=39
H=1
n=W/PM
PMCa3(PO4)2= Ca=3x40=120
P=2x31=62
O=8x16= 128
Total: 310g/mol
nCa3(PO4)2= 1gCa3(PO4)2
___________
310g/mol Caa3(PO4)2
=0,003 n
H2SO4 en 10g PMH2SO4= H=2x1 2
S= 1x32=32
O=4x16= 64
total: 98g/mol
nH2SO4= 10gH2SO4
___________
98g/molH2SO4
=0,102Nn
KOH en 5g PMKOH= K=1x39=39
O=1x16=16
H=1x1= 1
total:56g/mol
nKOH=5gHKOH
_________
56g/molKOH
=0,089n
10H2SO4--> x Eq-g?
5KOH--> x Eq-g?
1Ca3(PO4)2--> x Eq-g?
1. 1 eq-g KOH= 56g/mol
_________
1molOH
= 56g que pesa 1 eq-g KOH
5gKOH x (1eq-gKOH/56gKOH)= 0,089 eq-g KOH
Factor de conversión: Unidad dada= (unidad perdida/unidad dada)
2. 1 eq-g H2SO4= 98g/mol
_________
2 molesH+
= 49g que pesa 1eq-g H2SO4
10gH2SO4 x (1eq-g H2SO4/49g H2SO4)= 0,204 eq-g H2SO4
3. 1 eq-g Ca3 (PO4)2= 310 g/mol
__________
6mol C+
=51,666 que pesa 1 eq-g Ca3(PO4)2
1gCa3(PO4)2 x (1eq-g Ca3(PO4)2/51,6 Ca3(PO4)2) = 0,019 eq-g Ca3(PO4)2
Hicimos un taller en clases.
Comentarios
Publicar un comentario